- 肺CTスクリーニング報告データシステム(Lung-RADS)2022 炎症性または感染性の所見 02/26/26
-
炎症性または感染性の所見
肺CTスクリーニング検査における炎症性または感染性肺病変の正確な発生率は不明です。しかし、3,800人の患者を対象としたあるシリーズでは、全体の8.1%に炎症性または感染性の原因に起因する所見があり、そのほとんどは追跡画像診断で解消し、悪性腫瘍の発生率は1%未満であったことがわかりました。炎症性または感染性の所見は主に多巣性(78.5%)であり、すりガラス陰影(46.8%)、クラスター陰影(20.2%)、樹枝状結節(16.9%)、またはコンソリデーション(12.4%)で構成されていました。さらに、分節性または葉状のコンソリデーション、複数の新しい結節(6つ以上)、短い間隔で出現する大きな充実性結節(≥ 8 mm)、および特定の臨床状況(例:免疫不全患者)での新しい結節は、感染性または炎症性の可能性が高い。感染性または炎症性の可能性のある肺疾患の所見は多様であるため、データから単一の分類および管理推奨事項を導き出すことはできません。Lung-RADS v2022では、以下のガイダンスを提供しています。1.不確定な感染性または炎症性プロセスを示唆する所見、あるいは分節性または葉性陰影など肺の一部を不明瞭にする所見は、Lung-RADS 0に分類し、消失までの時間を確保し、潜在的な疑わしい結節を除外するために、1~3ヶ月間隔のフォローアップが推奨されます。フォローアップ時には、最も懸念される所見に基づいて検査を再分類する必要があります。
2.感染性または炎症性プロセスよりも悪性腫瘍の可能性が高い所見は、サイズと構成に基づいて分類する必要があります。このような所見は、Lung-RADS 4Bのサイズ基準を満たす新たな固形または部分固形結節であることが多く、診断的または臨床的評価による管理が推奨されます。
3.感染過程を示唆する所見の中には、短期的な経過観察が必要ないものもあります(例:樹状突起状結節や3cm未満の新規のすりガラス結節)。これらの結節は、既存のサイズおよび組成基準を用いて評価し、最も疑わしい所見に基づいてLung-RADS分類および管理推奨を行います。多くの場合、Lung-RADS 2に相当し、12ヶ月ごとの検査が推奨されます。
ACR Lung-RADS v2022: Assessment Categories and Management Recommendations:JACR
- 肺CTスクリーニング報告データシステム(Lung-RADS)2022 傍胸膜結節 02/24/26
-
傍胸膜結節
スクリーニング検査で検出された胸壁周囲結節について、平均径(長軸径と短軸径の平均)10mm未満の境界平滑な固形、三角形、卵形、またはレンズ形の結節は良性と考えられ、肺内リンパ節である可能性が高いとされており、いくつかの研究では悪性腫瘍の発生率は0%であると示されています。
平均径6~10mmの固形結節の最大32%が傍胸膜結節(胸壁周囲、肋骨胸膜、縦隔周囲、または横隔膜周囲)であり、胸壁周囲結節に用いられるものと同様のサイズおよび形態学的基準を適用した場合、傍胸膜結節は悪性ではないことが示されています。
入手可能なデータは、位置に関係なく、胸壁・葉間裂周囲結節の分類と管理に関する推奨事項をすべての胸膜傍結節に拡大することで、偽陽性率が低下し、Lung-RADSの感度を低下させることなく特異度が向上することを示しています。ACR Lung-RADS v2022: Assessment Categories and Management Recommendations:JACR
- 肺CTスクリーニング報告データシステム(Lung-RADS)2022 非定型肺嚢胞 02/08/26
-
非定型肺囊胞
非定型肺囊胞に関連する肺癌発生率は1.1%。しかし原発性肺癌と診断された患者のうち初回CTで囊胞成分が認められた患者は9.3%。初回スクリーニングで見逃された癌の22%が嚢胞腔に関連していた。嚢胞性肺癌の前駆病変は、単房性の厚壁嚢胞、関連結節性嚢胞、多房性嚢胞として現れることが多い。
嚢胞性気腔に関連する肺癌嚢胞の画像特徴は、不均一な形状(91.2%)、関連結節成分(64.0%)、単房性嚢胞(63.6%)、壁肥厚(37.4%)、不整な境界(37.3%)だった。経時的画像診断では、結節の増大(68.5%)、壁肥厚の増加(48.3%)、嚢胞成分の拡大(40.4%)、または完全な固形結節への変化(12.4%)だった。肺癌を伴う場合、単房性嚢胞は壁肥厚や結節性などの追加的な特徴を呈し、多房性嚢胞は悪性腫瘍の可能性が高く嚢胞性肺癌の最大20%を占める。1.薄壁嚢胞(壁厚2mm未満の単房性嚢胞と定義)は良性とみなされる。多発性肺嚢胞はびまん性嚢胞性肺疾患を示唆する可能性があるが、問題となる特徴を示す嚢胞が同定されない限り、これらの病態はLung-RADSでは分類されない。
2.厚壁嚢胞は単房性で壁厚が2mm以上であり、均一、非対称、または局所的な壁結節として現れる場合がある。
3.多房性嚢胞は内部に隔壁を有し、すりガラス状または固形成分を伴う場合がある(図)。
4.厚壁かつ多房性嚢胞はLung-RADS 4Aに分類され、8mm以上の固形成分がある場合は、3ヶ月ごとの低線量CT(LDCT)またはPET/CTによる管理が推奨される。
5.厚壁嚢胞の壁肥厚または結節性の増大、多房性嚢胞の分房化の増大、あるいは多房性嚢胞内または多房性嚢胞に隣接する新たな陰影(結節性、すりガラス陰影、またはコンソリデーション)の増大は、4B分類に値し、適切な診断評価が推奨される。
6.嚢胞腔内(内生性)または壁に隣接(外生性)に結節を伴う非典型肺嚢胞は、最も疑わしい所見に基づいて分類および管理される。結節性壁肥厚を伴う嚢胞(例:厚壁嚢胞、Lung-RADS 4A)と、隣接結節を伴う薄壁嚢胞(結節の大きさと組成によって管理)との区別は困難な場合がある。判断に迷う場合は、より高いLung-RADS分類を選択する。
Lung-RADS v2022 Assessment Category 一覧Atypical pulmonary cysts in Lung-RADS v2022
非典型肺囊胞の悪性腫瘍リスクは明確に定義されていない。そのため、Lung-RADS表から「悪性腫瘍リスク」の列は削除された。リスク評価は通常、病変特異的であり、カテゴリー4Bの病変を除き、Lung-RADSの管理推奨事項では日常的に使用されていない。ACR Lung-RADS v2022: Assessment Categories and Management Recommendations:JACR
- 縦隔の基本解剖 02/05/26
-
上縦隔は、頭部、頸部、胸郭の間を構造物が通過するための導管としての空間です。前縦隔は胸部の保護的な性質を持ち、胸腺とそのすぐ後ろにある重要な心臓構造をクッションとして支える結合組織と脂肪組織で満たされています。中縦隔には心臓と大血管の根部があります。後縦隔は上縦隔の延長でもありますが、胸腔と腹腔の間を構造物が通過するための導管としてのスペースを提供しています。
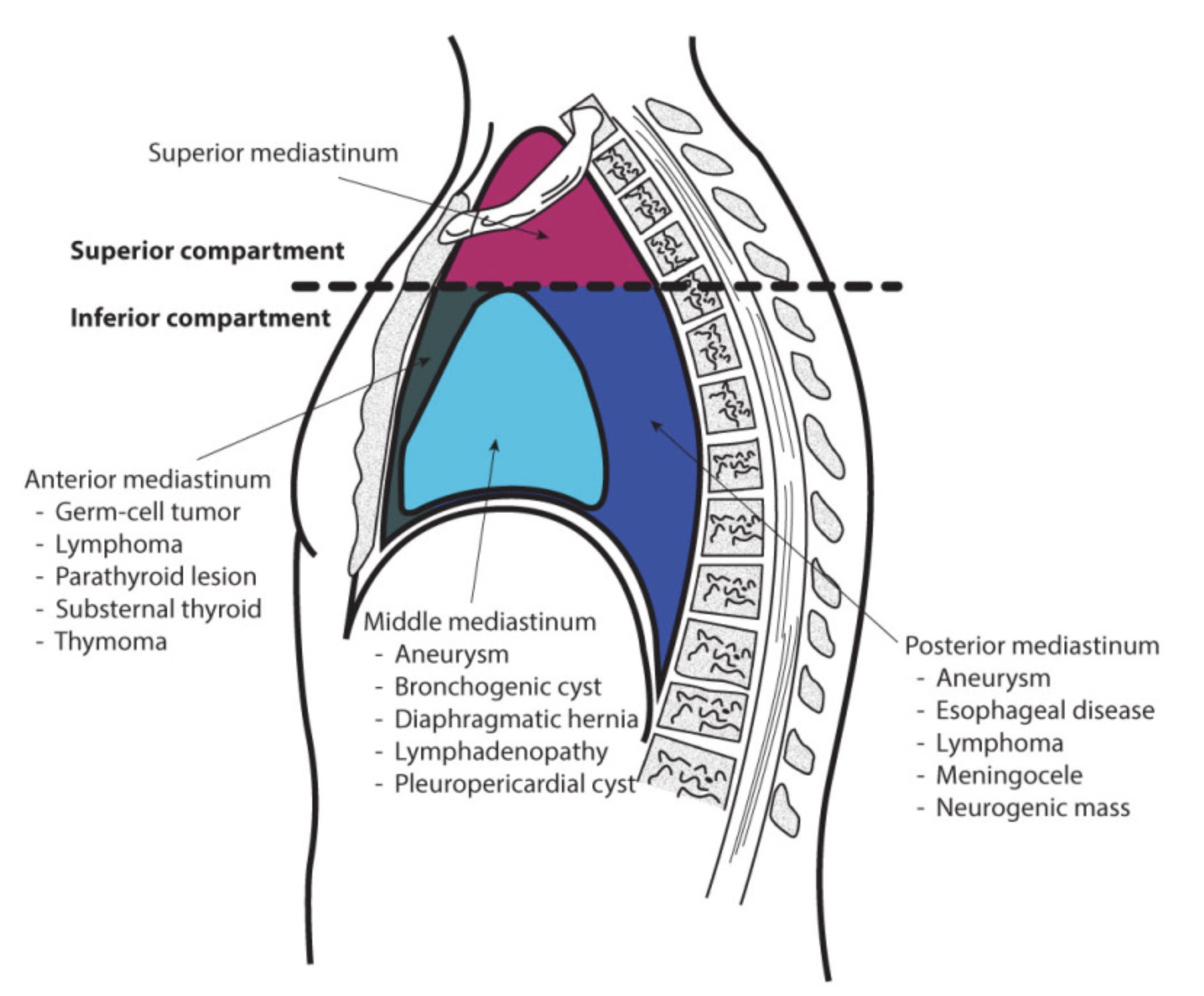
【縦隔区分】上縦隔、前縦隔、中縦隔、後縦隔、または 上部区画、下部区画に分けられます。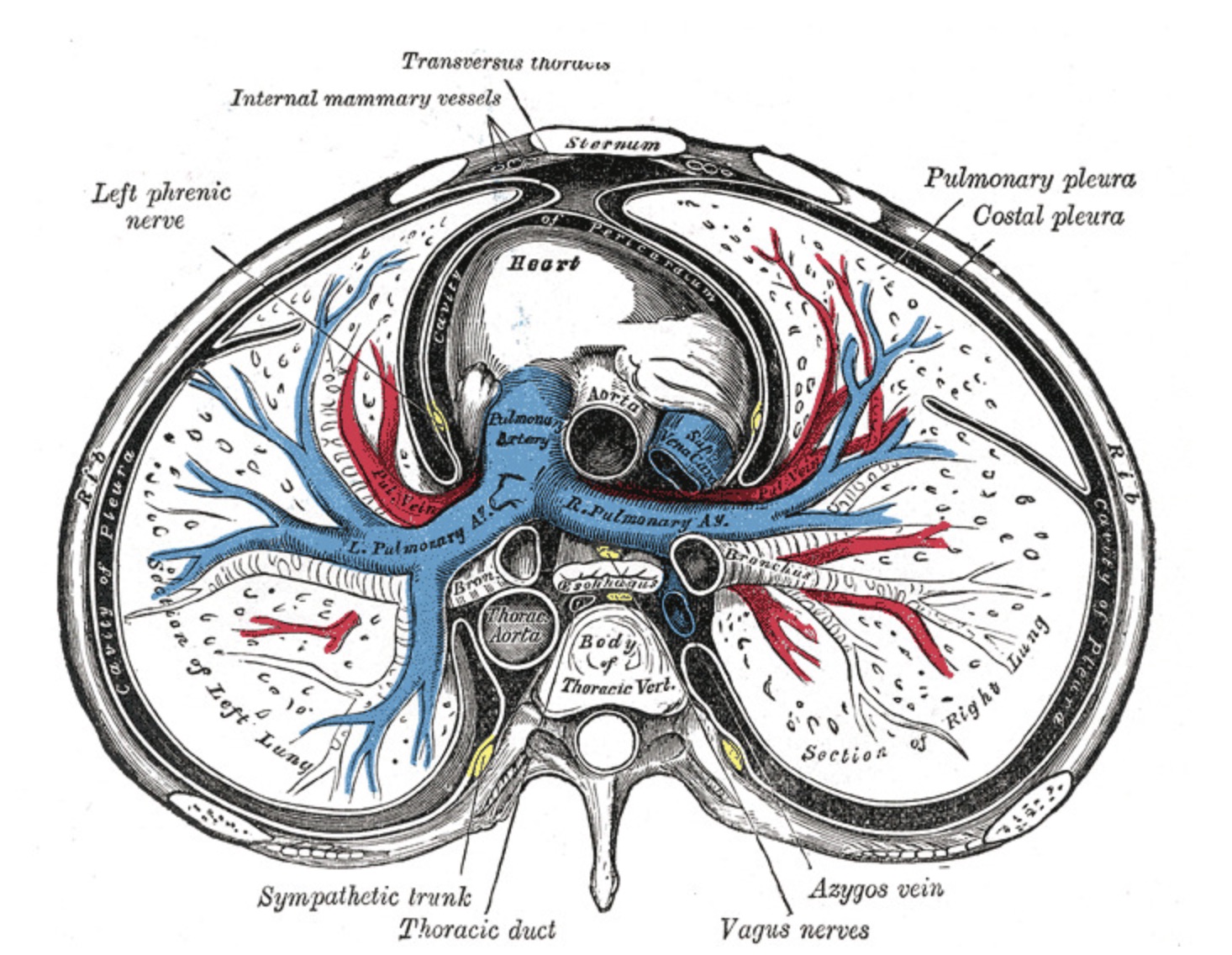
【Th6レベルでの縦隔/胸部の頭側横断面】中縦隔と後縦隔の内容物、左横隔神経、心臓、肺、臓側胸膜、および壁側胸膜。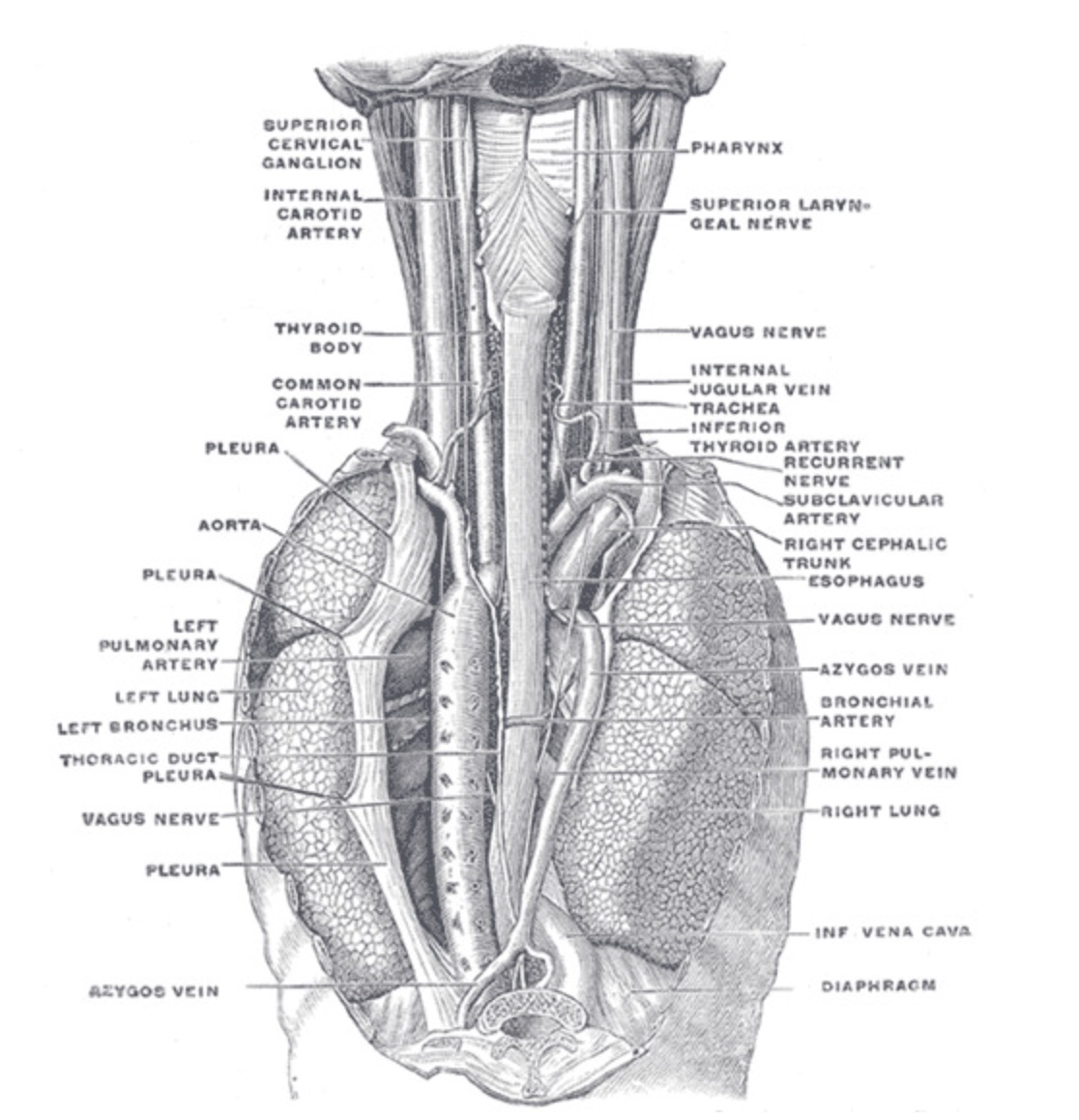
【咽頭、食道、および胸郭構造の後方図】咽頭、上頸神経節、内頸動脈、上喉頭神経、甲状腺、総頸動脈、内頸静脈、気管、下甲状腺動脈、反回神経、鎖骨下動脈、腕頭動脈、食道、胸膜、大動脈、左肺動脈、左肺、左気管支、胸管、奇静脈、右肺、気管支動脈、右肺静脈、下大静脈、横隔膜、頸部および胸郭に沿った迷走神経を示しています。上縦隔は、大きな血管と神経が通っているため、臨床的に重要な部位です。この部位への穿通創は、重要な血管や神経を損傷する可能性が高く、衝撃時だけでなく、抜去時にも重大な損傷をもたらします。動脈瘤の発生リスクが高い大動脈弓は、上胸部縦隔の中心を走っています。大動脈弓の動脈瘤は危険であり、長期間放置すると解離を起こし、ほぼ即死に至る可能性があります。上胸部縦隔には食道と気管の一部も含まれており、異物の摂取や吸入によって閉塞や損傷を受けやすい導管の役割を果たしています。
前縦隔の上部に位置する胸腺は、重症筋無力症、赤芽球癆、胸腺癌などの疾患を引き起こすことがあります。前縦隔は胸骨のすぐ後ろに位置するため、前胸部への外傷を受けやすく、胸郭内血腫や胸腺血腫を引き起こす可能性があります。
中縦隔は、心膜、心臓、大血管根を含むため、縦隔各部位の中で最も重要な区分と言えるでしょう。心筋梗塞、心嚢液貯留、心タンポナーデ、ファロー四徴症、心肥大などは、中胸部縦隔に発現する病態のほんの一例です。
後縦隔は、その臨床的重要性の大部分を、上胸部縦隔から下行する構造物に負っています。下行大動脈、自律神経系、広範囲に及ぶリンパ管、そして食道は、いずれも病態が存在すると広範な全身機能障害を引き起こす可能性があります。下行胸部大動脈瘤、胸管閉塞、遠位食道関連嚥下障害は、急速に生命を脅かす状況へと進展する可能性があります。
- 肺線維症と肺気腫の併発患者における肺がんリスク 01/25/26
-
肺線維症と肺気腫の合併(CPFE)と特発性肺線維症(IPF)および肺気腫患者における肺癌リスクが比較された。
2000年1月から2011年12月までにソウル大学病院で胸部CTスキャンによりCPFE、IPF、肺気腫と診断された患者の診療記録が後方視的に検討された。CPFE患者を登録し、放射線学的基準に基づきIPFおよび肺気腫患者と1:1:2の割合でマッチング。主要評価項目は肺癌の診断までの時間が評価された。
CPFE患者48名、IPF患者48名、肺気腫患者96名が含まれ、肺癌は25例発生した。 CPFE群は肺気腫群よりも肺がんリスクが高かった(調整HR 4.62、95%信頼区間1.58~13.55)。また、IPF群は肺気腫群よりも肺がんリスクが高かった(調整HR 4.15、95%信頼区間1.03~16.78)。しかし、CPFE群とIPF群の肺がんリスクには統計的に有意な差はなかった。さらに、CPFE群は肺気腫群よりも肺がんまたは死亡リスクが高かった(調整HR 4.62、95%信頼区間2.25~9.47)。
結論として、CPFEとIPFの患者は肺気腫の患者よりも肺がんリスクが高かったが、CPFEとIPFの肺がんリスクは同程度であった。
Lung cancer risk among patients with combined pulmonary fibrosis and emphysema: respiratory MEDICINE
- COPDは肺がん、大腸がん、肝がんなどの主要ながんの発症に寄与する 01/22/26
-
COPDは、喫煙行動とは無関係に、肺がんのよく知られた危険因子です。COPDが肺以外の主要な癌の危険因子であるという仮説を実証することを目指しました研究結果です。
12年間にわたるデータが分析されました。対象者514,795人のうち、2002年から2003年に癌と診断された16,757人を除外しました。このコホートには、COPDのない非喫煙者(313,553人)、COPDのない元喫煙者(41,359人)、COPDのない喫煙者(112,627人)、COPDのある非喫煙者(7,789人)、COPDのある元喫煙者(1,085人)、およびCOPDのある喫煙者(2,677人)の6群が登録されました。
10万人年あたりの肺がん発症率は、喫煙ありとCOPDありで高くなりました(非喫煙者では非COPDで216人、COPDで757人、元喫煙者では非COPDで271人、COPDで1,266人、喫煙者では非COPDで394人、COPDで1,560人)。
さらに、高齢、男性、BMIの低さ(やせ)、運動不足、糖尿病の既往、喫煙、およびCOPDは、肺がん発症に関連する独立した因子でした。
また喫煙の有無にかかわらず、COPDは肺がん、大腸がん、肝がんなどの主要ながんの発症に寄与することが示されました。
- 慢性閉塞性肺疾患(COPD)では、喫煙歴がなくとも肺がんになりやすい 01/21/26
-
ベースラインで肺がんの既往歴のない40歳から84歳までの338,548人が参加し、2,355,005人年(中央値7.0年)の追跡調査期間中に、1,834人が肺がんを発症しました。
COPDも喫煙者もどちらもない人達と比べた肺がん発症の完全調整ハザード比(95%信頼区間)は以下のとおりでした。COPDではあるが喫煙歴がない場合 2.67倍
COPDであってかつ喫煙経験ありの場合 6.19倍
COPDではないが喫煙経験ありの場合 1.97倍
この大規模全国コホート研究において、COPDは非喫煙者における肺がん発症の強力な独立危険因子でもあり、COPD患者は喫煙状況に関わらず肺がん発症リスクが高いことを示唆していました。
- 好酸球増多症候群(HES)の臨床症状と分類 01/13/26
-
HESは多様な臓器系が侵され、重症度も様々な多様な症状を呈する疾患です。最も一般的な徴候と症状は皮膚、肺、消化管の侵襲を反映していますが、どの臓器も侵される可能性があります。
(心) 好酸球性(壊死性)心筋炎、壁内血栓形成、心内膜心筋線維症
(皮膚)湿疹、蕁麻疹、紅斑性丘疹または斑、紅皮症、粘膜潰瘍、紫斑
(消化器)好酸球性消化管障害、胆管炎、肝炎
(血液)貧血、血小板減少症、脾腫
(腎・尿路)間質性腎炎、好酸球性膀胱炎
(神経)脳血管血栓症、脳卒中(心内血栓による塞栓症)、脳症、末梢神経障害
(肺)喘息、間質性肺浸潤、好酸球性気管支炎、胸水
(関節など)関節炎、腱鞘炎、筋膜炎
(鼻副鼻腔)慢性副鼻腔炎
(血管・凝固系)動脈または静脈の血栓症、微小血管障害、指の壊疽心血管系および神経系の合併症は、患者数が少ないものの、重大な罹患率および死亡率と関連しています。HESの病態は多様で、持続性または進行性の病態を呈する患者もいれば、症状が断続的に悪化する疾患活動性の変動(flare フレア)を経験する患者もいます。HESにはいくつかの亜型が定義されており、特発性HES(I-HES)では好酸球増殖のメカニズムが未解明です。リンパ球性HES(L-HES)では、好酸球増多は、好酸球増多因子性サイトカイン、特にインターロイキン(IL)-5を過剰産生する活性化T細胞のクローン集団によって引き起こされます。および骨髄性 HES (M-HES) であり、主に FIP1 様 1 (FIP1L1) 血小板由来増殖因子受容体アルファ (PDGFRA) 融合遺伝子と関連しています。
HES and EGPA Two Sides of the Same Coin:Mayo Clinic Proceedings
- 好酸球増多症候群(HES)と好酸球性多発血管炎性肉芽腫症(EGPA)という好酸球増多疾患 01/12/26
-
好酸球は、ヒトの健康と疾患において多様な役割を果たす顆粒球です。重症好酸球性喘息、鼻茸を伴う慢性副鼻腔炎、アトピー性皮膚炎など、多くの疾患において、血液中および/または組織中の好酸球数が増加することがあります。また、好酸球増多症候群(HES)や好酸球性多発血管炎性肉芽腫症(EGPA)など、しばしば顕著な血中好酸球増多を伴う稀な全身性疾患においても、好酸球数が増加することがあります。血中好酸球数が著しく増加するその他の原因としては、寄生虫感染症、癌、薬物有害反応などが挙げられます。
好酸球絶対数(AEC)が0.5×10^9個/Lを超えると、ほとんどの検査室では高値とみなされます。一方、好酸球増多症はAECが1.5×10^9個/L以上の場合と定義されています。
好酸球増多症候群(HES)は、持続的な好酸球増多と好酸球を介した末端臓器障害の証拠を特徴とします。HES の患者は、さまざまな臓器系(心血管・皮膚・消化器・血液・腎尿路・肺・副鼻腔・関節)の障害を呈し、多様な関連症状を示す可能性があります。
好酸球性多発血管炎性肉芽腫症(EGPA)の臨床症状も多様ですが、典型的には喘息と高度の好酸球増多を呈し、小血管炎や肉芽腫性好酸球性炎症のさまざまな全身症状(心血管・皮膚・消化器・腎尿路・肺・副鼻腔・関節)を示すことがあります。HES と EGPA の特定の臨床症状にはかなりの重複があり、血管炎の特徴がない場合には診断が困難な場合があります。治療の選択肢や治療への反応は疾患ごとに異なるため、正しい診断を下すことが重要です。最終的に、HES と EGPA はどちらも、制御不能または最適でない治療が行われた場合、重大な罹患率と死亡率につながります。HES and EGPA Two Sides of the Same Coin:Mayo Clinic Proceedings
- 好酸球性多発血管炎性肉芽腫症(EGPA) 12/04/25
-
eosinophilic granulomatosis with polyangitis:EGPA は、気管支喘息が先行し、多発性単神経炎などの血管炎症状で発症する疾患である。発症年齢40〜69歳が66%、平均年齢54.9歳、男女比1:1.7でやや女性に多い。日本の成人喘息のうち男0.2% 女0.5%がEGPAであり、ほとんどが45歳以上である。血管炎発症後数週間で虚血による致死的な消化管障害や心障害を呈する劇症型が数%存在する。10年生存率84%、20年生存率69%とされる。
成人発症の「重症」喘息が先行し、アトピー素因は強くないが末梢血好酸球増多が目立ち、好酸球性肺炎や好酸球性鼻副鼻腔炎(70〜80%)を合併している場合に疑われれる。喘息の初発から血管炎発症まで数年以内が多い。平均期間は9年である。しかし、この期間は患者によって異なり、全身性コルチコステロイドや免疫調節療法の使用によって影響を受ける可能性があり、10〜20年以上経ることもある。
血管炎症状として手足のしびれや筋力低下などの多発性単神経炎症状を90%以上に認める。他に、発熱、筋肉痛、体重減少などの全身症状(76%)、紫斑などの皮膚症状(51%)、心病変(16%)、消化管病変(16%)、腎障害(39%)が認められるが、心病変は予後規定因子であり、胸痛などの心症状がある場合は、80%で心エコー異常所見を認める。無症状でも半数で異常所見を認めるため、全例心病変の精査が必要である。診断基準における主要臨床所見は、(1)気管支喘息またはアレルギー性鼻炎 (2)好酸球増加 (3)血管炎症状:発熱38℃以上2週間以上、体重減少6ヶ月以内に6kg以上、多発性単神経炎、消化器出血、紫斑、多関節痛(炎)、筋肉痛(筋力低下)
MPO-ANCA陽性率は30〜40%であり、陰性でもEGPAを否定できない。EGPAのANCA陽性およびANCA陰性の症状は、それぞれ異なる遺伝子多型と関連している。MPO-ANCA陽性EGPAは、好酸球性自己免疫疾患と関連し、一般的に血管炎表現型(壊死性血管炎および壊死性糸球体腎炎)を発症するリスクが高く、腎病変、皮疹が多い。ANCA陰性EGPAは粘膜/バリア機能経路および2型炎症に関連し、好酸球性臓器浸潤の直接的な結果、心内膜・心筋障害を発症する可能性が高い。しかし、ANCA状態だけでは特定の患者の臨床症状を予測するのに十分な感度および特異度を示さず、治療決定の指針とはならない。
PR3-ANCA陽性率は10%以下である。予後不良因子は、①65歳以上 ②心症状 ③消化管病変 ④腎機能低下 ⑤耳・鼻・咽頭といった上気道病変がない である。
血管炎症状発症から治療開始までの期間が2週間以内では末梢神経機能回復率は75%だったが、40日以上では不可逆的な神経障害に至る。
HES and EGPA Two Sides of the Same Coin:Mayo Clinic Proceedings
日本医師会雑誌 第153巻特別号(2)好酸球性多発血管炎性肉芽種症(EGPA)
- 薬剤誘発性好酸球性肺炎 11/27/25
-
原因が明らかな好酸球性肺疾患(3)
薬剤誘発性好酸球性肺炎は、好酸球増多および好酸球性肺浸潤を呈し、重症呼吸器症候群を引き起こすことがあります。抗生物質、抗炎症性非ステロイド薬、抗不整脈薬など多くの薬剤が好酸球性肺炎の原因になります。アミオダロン(抗不整脈薬)、アムホテリシンB(抗真菌薬)、エタンブトール(抗結核薬)、イソニアジド(抗結核薬)、ジフェニルヒダントイン(神経薬)、カルバマゼピン(神経薬)、トラゾドン(神経薬)、GM-CSF(免疫調節薬)、ブレオマイシン(化学療法薬)、メトトレキサート(化学療法薬)、プロカルバジン(化学療法薬)、エトポシド (化学療法薬)、ミノサイクリン(抗生物質)、テトラサイクリン(抗生物質)、スルホンアミド系(抗生物質)、ニトロフラントイン(抗生物質)、スルファサラジン(抗生物質)、マイトマイシンC(抗生物質)、パラアミノサリチル酸(抗炎症薬)、NSAIDs(抗炎症薬)、ペニシラミン(抗炎症薬)
さらに、放射線療法も好酸球性肺炎の原因になります。薬剤誘発性好酸球性肺炎の診断には、特発性急性好酸球性肺炎や慢性好酸球性肺炎といった診断基準が用いられるため、特に薬剤との一時的な関連性がある場合は、強い疑いを持つ必要がある。ただし、好酸球性肺炎は慢性的な薬剤使用によって発症することもある。薬剤誘発性好酸球性肺炎の病態生理は、肺胞マクロファージによる抗原産生と、それに伴うTヘルパー2リンパ球の集積、そしてそれに続くインターロイキン2の放出に関連している。興味深いことに、アミオダロン誘発性慢性好酸球性肺炎は、II型肺胞上皮細胞に対する細胞傷害作用、免疫介在性メカニズム、およびアンジオテンシン酵素系の活性化が組み合わさって引き起こされる。異なる薬剤によって引き起こされる急性好酸球性肺炎と慢性好酸球性肺炎には、共通の病態経路が根底にある可能性がある。一般的に、薬剤誘発性好酸球性肺炎に罹患した患者は、ステロイド治療および薬剤中止に良好な反応を示し、機械的人工呼吸器を必要とする患者はほとんどいません。
- アレルギー性気管支肺真菌症(アスペルギルス症) 11/25/25
-
原因が明らかな好酸球性肺疾患(2)
アレルギー性気管支肺真菌症(allergic bronchopulmonary mycosis: ABPM)(アレルギー性気管支肺アスペルギルス症:ABPA)アレルギー性気管支肺アスペルギルス症(ABPA)は、アスペルギルス属に対する過敏症反応であり、喘息および嚢胞性線維症の患者に最も多くみられます。喘息患者の2〜3%に発症するとされているが、日本人では患者の20%に先行する基礎疾患がない。小児発症はまれで、発症年齢中央値は60歳前後。感染症とアレルギー疾患の両方の性格を持っています。気管支の中に粘液栓の形で住み着いているアスペルギルスの塊に対してアレルギー反応が起こっている病態です。HRCT検査では、中枢性気管支拡張症、(中枢気管支内)高吸収性粘液栓子(喘息の粘液栓とは異なり、中枢気管支優位・気管支拡張を伴う、CT値の高い高吸収粘液栓(high attenuation mucus:HAM)、肺結節、浸潤影が認められます。
末梢血好酸球増多(ピーク時≧500/μL)とアスペルギルス特異的IgE値の上昇、(血清総IgEピーク時≧417 IU/mL)そして適切な臨床状況における典型的な画像所見がABPAの診断に有用です。
典型的な顕微鏡的形態学的特徴としては、大気道壁への著明な好酸球浸潤、気管内粘液を含むシート状および好酸球クラスター、そしておそらくシャルコー・ライデン結晶(「アレルギー性ムチン」)などが挙げられます。グロコット・メテナミン銀染色(GMS染色)などの真菌染色では、真菌菌糸の残存が明らかになる場合と明らかにならない場合があります。ABPAは真菌に対する過敏症反応であり、真菌への曝露は示唆されますが、必ずしも感染とは限らないため、真菌菌糸の存在は必須ではありません。ABPAの治療は、一般的に吸入コルチコステロイドと経口コルチコステロイドが用いられますが、特定の症例では抗真菌療法や、例えばIgEやIL-5を標的としたモノクローナル抗体が有用です。
- レフラー症候群 11/24/25
-
原因が明らかな好酸球性肺疾患(1)
特発性の好酸球性肺炎の診断においては、原因が明らかな好酸球性肺疾患を除外する必要があります。レフラー症候群
レフラー症候群は、単純性肺好酸球増多症(SPE)とも呼ばれ、一過性の肺浸潤、呼吸器症状の欠如または軽度の呼吸器症状、および末梢血好酸球増多を特徴とする好酸球性肺疾患です。無症状の健常者におけるSPEの有病率は約0.9%と報告されています。
HRCTでは、移動性で一時的な非区域性の肺胞性透過性低下が認められ、片側性または両側性で主に末梢に分布します。すりガラス陰影に囲まれた充実性結節(ハローサイン)が認められる場合があります。胸水およびリンパ節腫脹は認められません。
レフラー症候群様症候群は、回虫(Ascaris lumbricoides)および十二指腸鉤虫(Anchilostoma duodenale)による蠕虫感染症後に発症することがあります。高リスク患者では顕微鏡検査および血清学的検査を実施されることがあるが、最大3分の1の患者では原因が特定できません。
レフラー症候群は1ヶ月以内に自然治癒することが多く、治癒しない場合はコルチコステロイドによる治療が推奨されます。 - 慢性好酸球性肺炎 11/05/25
-
慢性好酸球性肺炎(CEP)は、間質性肺疾患の1~3%を占めると推定されています。CEPは、組織および末梢血中での顕著な好酸球増多を特徴とし、他の好酸球性肺疾患を除外した上で、臨床症状と臨床検査所見に基づいて診断されます。
男女比は1:2で、小児から高齢者までどの年齢でも起こりうるが、30~45歳に最も多く発症します。典型的には非喫煙者であり、最大3分の2は成人発症喘息の既往歴を有し、約半数は以前にアトピーまたはアレルギー性鼻炎の既往歴を有しています。
通常、数週間から数ヶ月かけて軽微かつ緩徐進行性の呼吸器症状を呈しますが、明らかな呼吸不全はまれです。呼吸困難、咳嗽、微熱、寝汗、倦怠感、意図しない体重減少などの全身症状がよく見られます。呼吸器症状は通常2週間以上持続し、肺以外の症状はまれです。画像上肺炎を疑うコンソリデーションを認め、抗菌薬に反応しない場合、投与している抗菌薬に不応性の感染症の他に非感染性病態として考慮しなければならない。
活性化マーカーを発現する好酸球の肺浸潤と、浸潤した好酸球からの炎症性サイトカインの放出が、CEP発症につながる病態機序として提唱されています。最近では、クローン血および肺T細胞の増殖が病態に関与している可能性も示唆されています。
画像診断におけるコンソリデーション、血中好酸球増多、BAL好酸球増多、およびステロイド治療への反応の組み合わせは、多くの場合診断に十分であり、肺生検の必要性を回避します。しかし、特発性器質化肺炎(COP)ではBALで好酸球がわずかに増加している場合があり、HRCT所見が類似している可能性があるため、CEPと器質化肺炎(OP)の鑑別は困難な場合があります。しかし、CEPではOPと比較して、気管支血管周囲にコンソリデーションが現れる頻度が低く、逆ハロー徴候を示す頻度も低い。
診断基準:慢性好酸球性肺炎は、2~4週間持続する呼吸器症状、エアブロンコグラムおよび/またはすりガラス陰影を伴うびまん性肺胞性コンソリデーション、BAL洗浄液中の好酸球増加(好酸球率≥40%)または末梢血好酸球増加(≥1,000/mm³)、および好酸球性肺炎の他の既知の原因がないことです。
胸部X線写真における「特徴的」所見である高密度な周辺性浸潤影(肺水腫の「写真ネガ」と表現される)は、症例の50%未満にしか認められない。CEPにおけるHRCT所見は、典型的には両側の中~上肺野の非区域性・胸膜直下優位で外側2/3に及ぶ、高密度で斑状の浸潤影およびすりガラス陰影を示す。より稀な放射線学的所見には、逆ハローサイン、間質肥厚、結節性浸潤影、縦隔リンパ節腫大、気管支壁肥厚、胸水貯留が含まれる。症状が数か月持続している場合、治療後も画像上では胸膜面に平行な線条状の陰影や肺葉性無気肺が認められることがある。これらの線条状陰影は肺裂によって分断されない。
血中好酸球増多は患者の66~95%に認められ、白血球分画の20~30%を好酸球が占めます。血清IgE値は患者の約半数で上昇することがあります。BAL中の好酸球増多は、通常、コルチコステロイド治療前の総細胞の40%を超えており、常に認められ、適切な臨床状況においてはしばしば診断に有用です。IL-5値は血清およびBALの両方で上昇しますが、必ずしも肺の好酸球増多の程度と相関するわけではありません。
CEPの組織病理学的所見には、肺胞腔および肺胞中隔への多数の好酸球浸潤が含まれます。これらの浸潤は、マクロファージやリンパ球などの他の慢性炎症細胞を伴うことがあります。核デブリを伴う可能性のある好酸球の大きな塊は、好酸球性微小膿瘍を形成することがあります。アレルギー性気管支肺アスペルギルス症では、好酸球性顆粒やシャルコー・ライデン結晶が出現することもあります。背景肺実質の構造は保持されます。好酸球性膿瘍、非壊死性血管周囲炎症を伴う気道病変、II型肺胞上皮細胞の過形成、間質リンパ球、器質化肺胞内フィブリンも認められることがあります。OPの病巣がしばしば認められます。
迅速なステロイド治療はCEPの予後を改善します。しかし、AEPとは異なり、再発を予防し完全寛解を得るためには、長期にわたる低用量経口コルチコステロイド療法が必要です。コルチコステロイドはCEPの治療選択肢であり、患者は通常劇的な反応を示します。 CEPに対する最適なコルチコステロイドレジメンは未だ確立されていないが、通常はプレドニゾン0.5 mg/kg/日の投与から開始し、約4~6週間投与することで、画像上の異常は通常消失する。その後、用量を0.25 mg/kg/日まで漸減し、さらに8週間投与を継続した後、さらに毎月5 mgずつ漸減する。再発は一般的であり、最大50%の患者が病勢コントロールを維持するために長期の低用量経口コルチコステロイドまたは高用量吸入コルチコステロイドを必要とする可能性がある。再発時には高用量コルチコステロイドが投与されることが多い。ステロイド治療が長期にわたる場合は、骨粗鬆症やニューモシスチス肺炎の予防が必要になる。最近では、抗IgE抗体(オマリズマブ)、抗IL-5抗体(メポリズマブ)、抗IL-5受容体抗体(ベンラリズマブ)などの生物学的製剤が、CEPのステロイド節減治療の代替となる可能性がある。
Acute and chronic eosinophilic pneumonia: an overview : Frontiers in Medicine
- 急性好酸球性肺炎 11/03/25
-
急性好酸球性肺炎(AEP)は、特発性急性好酸球性肺炎とも呼ばれ、原因不明の疾患です。とても稀な疾患で正確な有病率は不明です。AEPは、20~40歳の男性で、喫煙者であり、アトピーの既往歴のない人に最も多く見られます。
その病因はよくわかっていません。吸入抗原に対する急性過敏反応が原因であると考えられています。喫煙開始直後、喫煙習慣や銘柄の変化、喫煙再開、あるいは短期間の受動喫煙、電子タバコの使用、防水スプレー・花火煙・粉塵などの吸入汚染物質への環境曝露など、様々な呼吸器系への曝露によって引き起こされる可能性があります。抗生物質、非ステロイド性抗炎症薬(NSAID)、選択的セロトニン再取り込み阻害薬(SSRI)などの薬剤や、寄生虫感染症、真菌感染症、ウイルス感染症にも関連する可能性があります。
提唱されている病態モデルでは、気道および上皮の損傷がインターロイキン(IL)-33の産生を誘導し、好酸球の集積、浸潤、およびこれらの細胞の脱顆粒を引き起こし、炎症過程へと進展することが示唆されています。
症状は重症市中肺炎および急性呼吸窮迫症候群(ARDS)に類似しており、(5日以内の急性の)発熱、乾性咳嗽、呼吸困難、低酸素血症、および肺浸潤が7日以内に出現する(急性経過・急性呼吸不全)。人工呼吸器を必要とする重症低酸素性呼吸不全がよく見られます。明らかな誘因なくARDS様症候群を呈する患者では、AEPの診断を考慮すべきである。
急性好酸球性肺炎は、発熱を伴う急性発症、両側びまん性浸潤影、室内気酸素飽和度90%以下、肺胞洗浄液(BAL)好酸球増多(好酸球25%以上)、および他の既知の好酸球性肺炎の原因がないことを特徴とする。間質性肺炎としてfine cracklesが聴取され、抗菌薬への反応に乏しく、呼吸不全へと進行する急性肺炎の場合に鑑別に挙がる。
病理では、気管支壁、間質および/または肺胞腔に、間質浮腫および好酸球浸潤を認める、びまん性肺胞障害(diffuse alveolar damage:DAD)を呈する。
画像診断では、典型的にはARDSに類似する対称性の肺胞および間質浸潤が認められ、胸水は最大70%の患者に認められる。高解像度コンピュータ断層撮影(HRCT)所見には、以下のものがある:(1) すりガラス陰影 (2) 小葉中隔肥厚 (3) 胸水(症例の60~100%)(4) 気管支血管束の肥厚 (5) 気腔の硬化 (6) 小葉中心結節。特に、AEP画像は心原性肺水腫またはARDSに類似することがある。臨床検査所見では、白血球増多は一般的であるが、血中好酸球増多は発症時にはしばしば認められず、疾患の経過中に出現することがある。適切な臨床状況において、BAL中に少なくとも25%の好酸球が含まれている場合、通常は診断が確定する。AEPでは、慢性好酸球性肺炎よりも好酸球増多のレベルが低いにもかかわらず、BAL中のIL-5値が高いことが報告されている。
コルチコステロイドの全身投与に対して速やかに反応し、ステロイド治療後に再発がないことが診断基準に含まれる。プレドニゾロン換算40~60mg/日で治療した場合、1週間以内に改善を認める。
Acute and chronic eosinophilic pneumonia: an overview :Frontiers in Medicine